Proyectos
Referencia | CA20121
Fecha de ejecución | 19/10/2021 – 18/10/2025
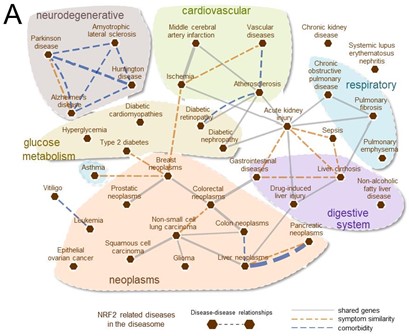
Non-communicable diseases (NCDs) account for 77% of all deaths in Europe and remain the most prevalent and without effective therapy.
The transcription factor NRF2 is a master regulator of multiple cytoprotective responses and a key molecular link among many NCDs. It provides a unique strategy for drug development and repurposing that is now starting to be translated to the pharmacological and clinical arena.
This Action will build a network of excellence for integrating and spreading the existing knowledge and providing innovative services, drugs and tools related to NRF2-pharmacology, with the final goal of boosting the translation to the European industry sector.

Desarrollo de fármacos activadores de NRF2 para terapias innovadoras de la enfermedad de Alzheimer
Referencia | S2017/BMD-3827
Fecha de ejecución | 01/01/2018 – 30/06/2022
La enfermedad de Alzheimer (EA), principal causa asociada a la demencia es la enfermedad neurodegenerativa (END) más prevalente actualmente, con más de 46 millones de personas afectadas en todo el mundo. Teniendo en cuenta su relación directa con el envejecimiento, se estima que esta cifra aumente hasta superar los 100 millones en el año 2050. La EA tiene un tremendo impacto social, debido a la pérdida de calidad de vida y de autonomía (tanto para el paciente como para sus familiares / cuidadores), y también económico, para los sistemas nacionales de salud, estimado actualmente en 818.000 millones de dólares a nivel global.
A pesar del esfuerzo humano y económico invertido, en los últimos 15 años no ha habido ningún fármaco nuevo en la práctica clínica para el tratamiento de la EA, y la eficacia de los que se usan habitualmente no es satisfactoria.



Interacción entre la neuroinflamación, el estrés oxidativo y la proteinopatía: nuevas dianas para prevenir la neurodegeneración en la EA.
Referencia | RTI2018-095793-B-I00
Fecha de ejecución | 01/01/2018 – 30/06/2022

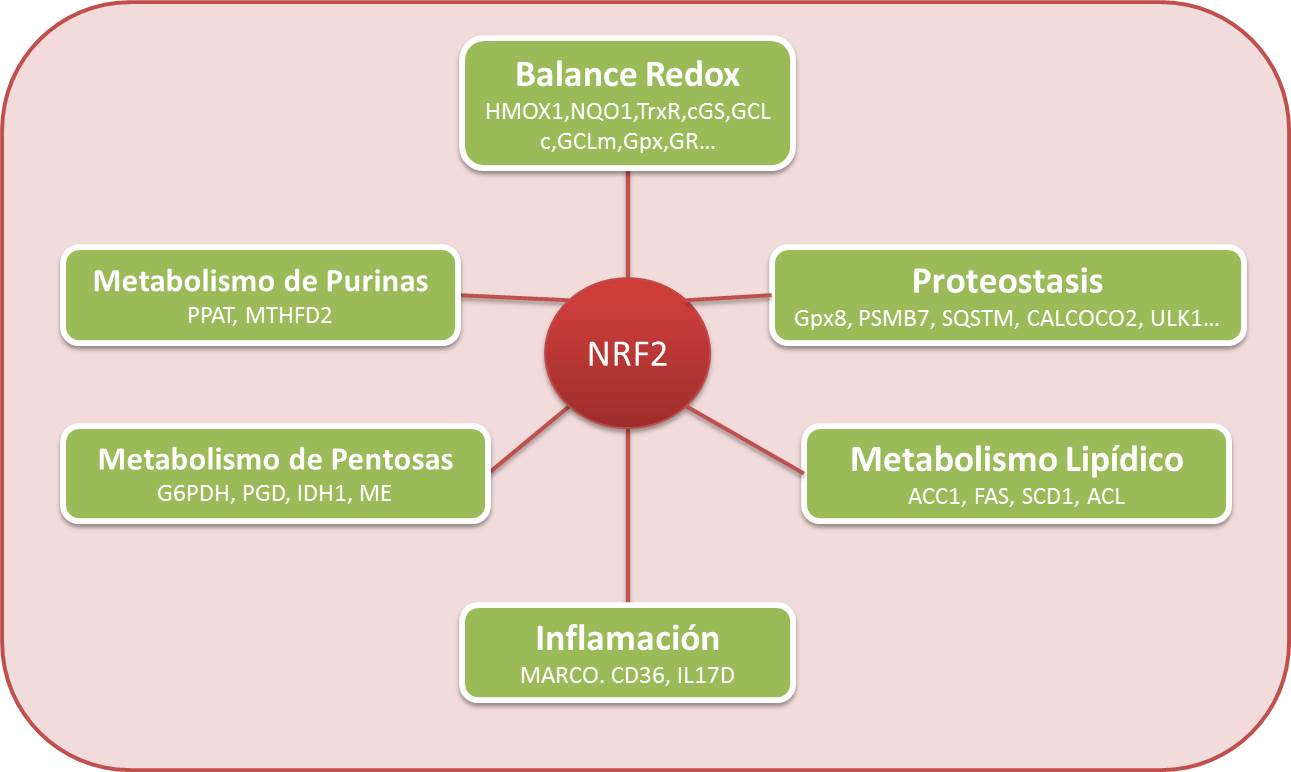
Entre las diferentes enfermedades neurodegenerativas (END), la enfermedad de Alzheimer (EA) es el trastorno neurocognitivo más común con importantes impactos sociales y económicos. Hasta la fecha, ningún medicamento nuevo ha sido aprobado para incorporarse al arsenal terapéutico actual que comprende los inhibidores de la acetilcolinesterasa y el antagonista del receptor NMDA memantina. Existen evidencias acumuladas que muestran que la neuroinflamación crónica, no remitente y de bajo grado, el estrés oxidativo, la disfunción mitocondrial y la proteostasis /autofagias alteradas son procesos interconectados que actúan de manera coordinada y reverberante, causando neurodegeneración. Por lo tanto, hipotetizamos que, al actuar sobre estos procesos, que se alteran en las fases iniciales de la neurodegeneración, las posibilidades de mejorar el impacto en la prevención/ reducción de la progresión de la enfermedad pueden ser mayores. En este contexto, el proyecto que se propone se centrará en cómo ciertas enzimas tales como HO-1 (regulación de la inflamación / estrés oxidativo) y NADPH oxidasa 4 (enzima activa constitutiva responsable de la producción de especies reactivas de oxígeno), y PGC-1alfa; (regulador principal de la biogénesis mitocondrial) impactan en el estrés oxidativo, la neuroinflamación y los marcadores de flujo de autofagia para regular la neurodegeneración y la demencia.

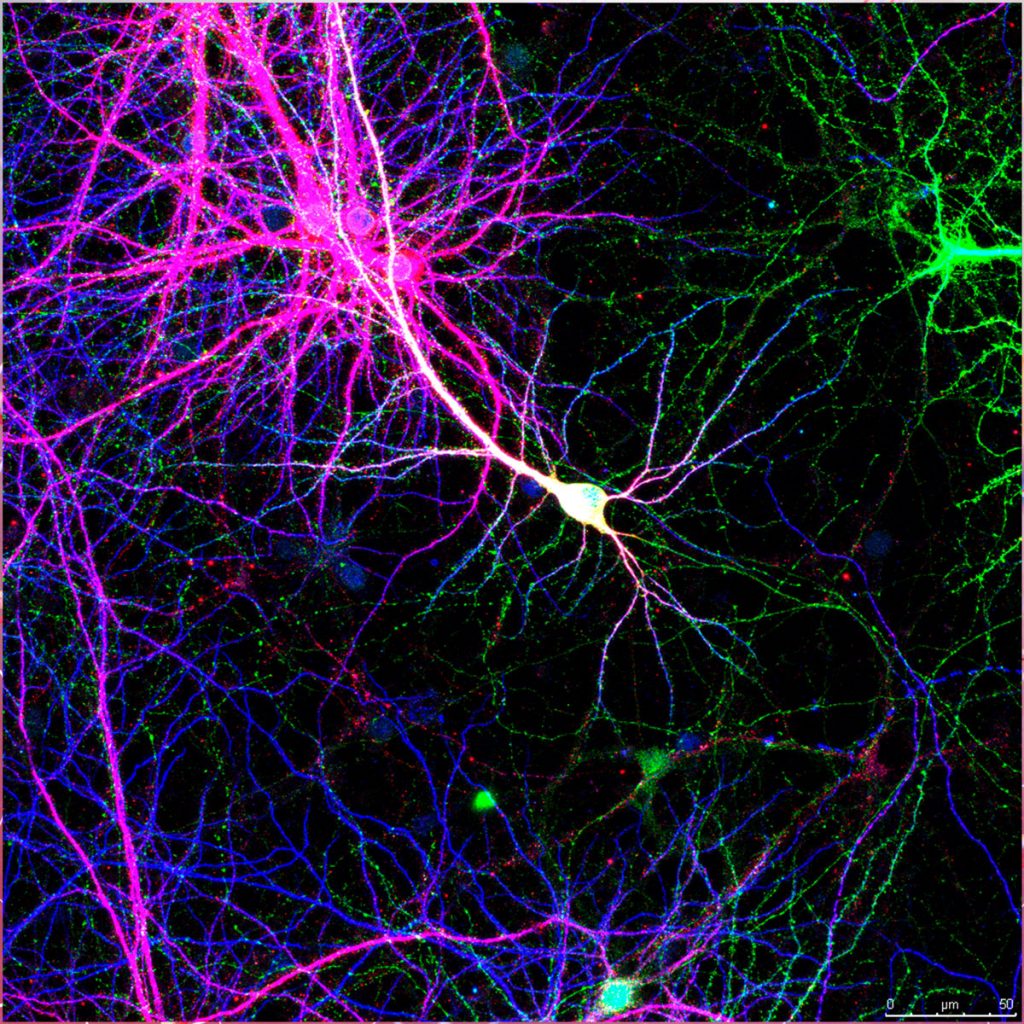
Cultivo primario de neuronas: En color verde se aprecia la morfología y espinas dendríticas de neuronas positivas para la proteína verde fluorescente (GFP). En color rosa, neuronas positivas para la proteína tau fosforilada, y en color azul la totalidad de las neuronas del cultivo.
RED2018‐102362‐T. Red de investigación traslacional sobre la regulación farmacológica de NRF2 en enfermedades no transmisibles. MINECO. PI. Antonio Cuadrado. UAM. 01/12/2019-1/12/2020.
SAF2015-63935R. Exploración del eje alfa-7nAChR/Nrf2/HO-1 en la interacción microglía-neurona y su impacto en los procesos de neurodegeneración y neuroprotección. MINECO. PI: Manuela G. López. UAM. 01/01/2016 – 31/12/2018.
COST Action BM1203:EU-ROS. EU-ROS: The European Network on Oxidative Stress and Redox Biology Research. Coordinador: Andreas Daiber. 05/12/2012-04/12/2016. Manuela G. López. Miembro sustituto del Comité ejecutivo en representación de España.
SAF2012-2332.Control colinérgico de la neuroinflamación y su participación en la neuroprotección. MINECO. PI: Manuela G. López. 01/01/2013-31/12/2015.
SAF2009-12150. Contribución de los receptores nicotínicos a la neuroprotección y a la neuroinflamación. MICINN. PI: Manuela G. López. 01/01/2010 – 31/12/2012.





